1. ĐẠI CƯƠNG
Lọc máu (blood purification) có hai chức năng chính là (1) hỗ trợ chức năng các tạng suy (như gan, thận) và (2) loại bỏ các chất trung gian gây bệnh (như trong sốc nhiễm khuẩn, hội chứng suy hô hấp cấp tiến triển – ARDS, viêm tụy cấp nặng). Lọc máu liên tục với những ưu điểm lớn như áp dụng được trên bệnh nhân có huyết động không ổn định, loại bỏ được các chất có khối lượng phân tử trung bình đến lớn, đang được áp dụng ngày càng phổ biến, chỉ định ở bệnh nhân tổn thương thận có rối loạn huyết động cũng như các chỉ định ngoài thận, góp phần cứu sống nhiều bệnh nhân nặng.
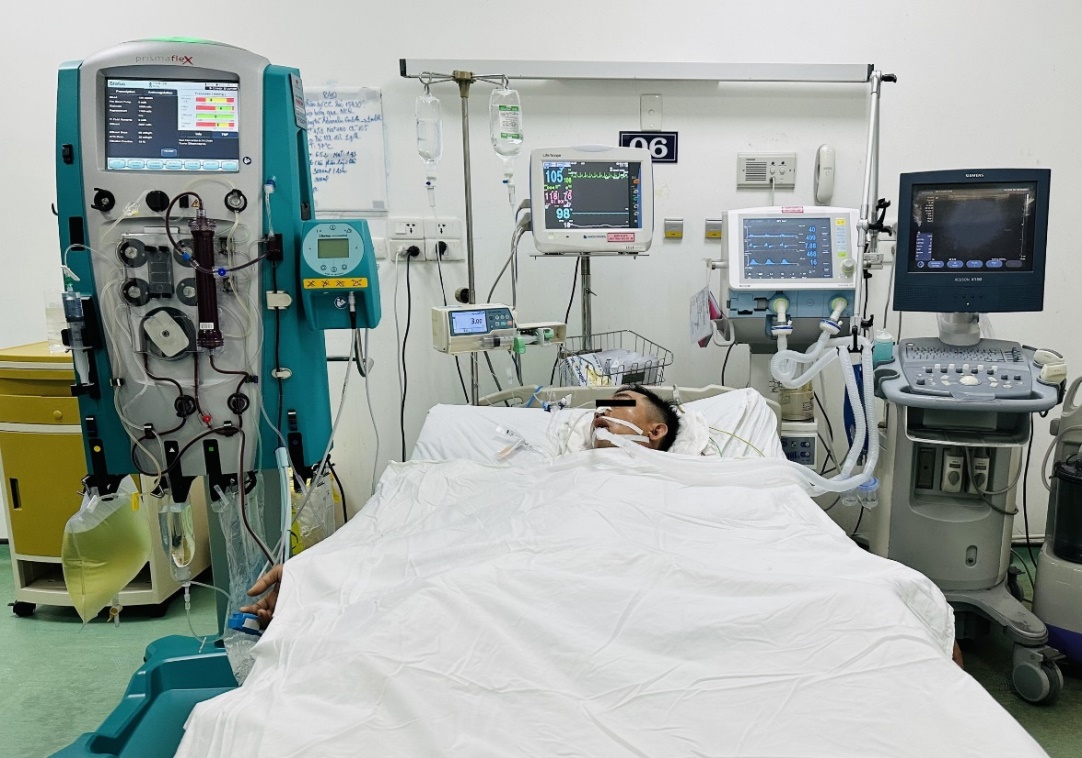
Hình 1. Lọc máu liên tục tại Đơn vị Hồi sức tích cực, Khoa Gây mê Hồi sức – Cấp cứu – Chống độc , BV Trường Đại học Y Dược Huế
2. NGUYÊN LÝ CỦA LỌC MÁU LIÊN TỤC
Máu bệnh nhân được lấy ra từ một tĩnh mạch lớn, thường là tĩnh mạch đùi, cảnh trong, dưới đòn thông qua một bơm máu (phổ biến là bơm con lăn) với tốc độ kiểm soát, dẫn vào vòng tuần hoàn ngoài cơ thể theo dây dẫn. Máu này được chống đông trước khi chảy vào quả lọc, tại quả lọc tùy theo phương thức lọc cài đặt trước và tính chất màng lọc mà sẽ xảy ra quá trình loại bỏ các chất bằng cơ chế khuếch tán, siêu lọc, đối lưu, hấp phụ. Máu sau đó đi ra khỏi quả lọc và trả lại người bệnh qua nòng còn lại của catheter.
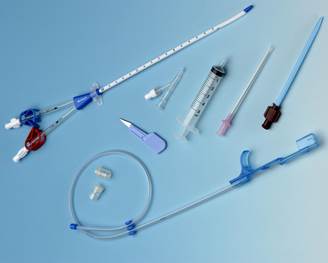
Hình 2. Bộ catheter trong lọc máu liên tục
Cơ chế loại bỏ nước và các chất trong lọc máu liên tục
Các chất độc, chất trung gian gây bệnh nội sinh hoặc ngoại sinh, nước, điện giải được loại bỏ khỏi máu theo bốn cơ chế chính là (1) khuếch tán, (2) siêu lọc, (3) đối lưu và (4) hấp phụ.
2.1. Khuếch tán
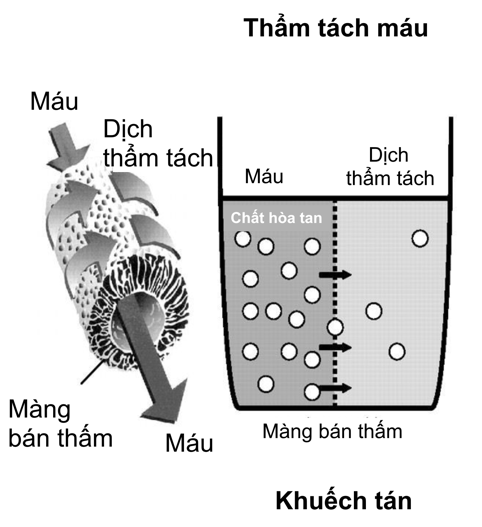
Hình 3. Cơ chế khuếch tán
Trong cơ chế khuếch tán, máu và dịch thẩm tách được ngăn cách nhau bằng một màng bán thấm, chảy liên tục theo hướng ngược chiều nhau. Các chất hòa tan sẽ khuếch tán qua màng theo chiều từ máu sang dịch thẩm tách hoặc ngược lại tùy theo chênh lệch nồng độ giữa hai khoang (từ nơi nồng độ cao đến nơi nồng độ thấp), cho đến khi nồng độ chất giữa hai khoang cân bằng. Kỹ thuật lọc máu sử dụng cơ chế khuếch tán này được gọi là thẩm tách máu – hemodialysis. Thẩm tách máu có mặt trong các mode lọc thẩm tách máu tĩnh mạch – tĩnh mạch liên tục (CVVHD - Continuous veno-venous hemodialysis), siêu lọc – thẩm tách máu tĩnh mạch – tĩnh mạch liên tục (CVVHDF - Continuous veno-venous hemodiafiltration). Cơ chế khuếch tán chỉ có hiệu quả với các chất có khối lượng phân tử nhỏ (< 500 – 1500 Daltons), hiệu quả khuếch tán giảm nhanh khi khối lượng phân tử tăng.
2.2. Siêu lọc
Siêu lọc là hiện tượng nước trong huyết tương di chuyển qua màng bán thấm thông qua sự chênh lệch áp lực thủy tĩnh giữa khoang máu với khoang dịch thẩm tách/dịch siêu lọc, hay được gọi là áp lực xuyên màng (TMP - transmembrane pressure). Các máy lọc máu hiện đại điều chỉnh sự chênh lệch áp lực này bằng cách thay đổi áp lực âm (lực hút) trong khoang dịch thẩm tách/dịch siêu lọc hơn là tăng áp lực trong khoang máu, điều này giúp hạn chế tình trạng tan máu.
Khả năng thấm nước của một màng lọc được thể hiện qua hệ số siêu lọc (Kuf), đơn vị là mL nước/giờ/mmHg. Màng lọc “high flux” có Kuf từ 10 – 50 mL/giờ/mmHg, trong khi màng lọc “low flux” có Kuf dưới 10 mL/giờ/mmHg.
Lưu lượng siêu lọc (QF) là lưu lượng nước di chuyển qua màng bằng cơ chế siêu lọc, được tính theo công thức:
QF = Kuf x TMP
Màng lọc sử dụng lâu, các lỗ lọc sẽ dần bị bít tắc bởi protein, huyết khối.
2.3. Đối lưu
Đối lưu là hiện tượng các chất hòa tan di chuyển qua màng lọc thông qua lực lôi kéo của dòng dịch siêu lọc. Đối lưu có thể vận chuyển những phân tử rất lớn, miễn là kích thước đủ qua được lỗ màng (< 50000 Daltons) và lưu lượng dịch siêu lọc đủ lớn.
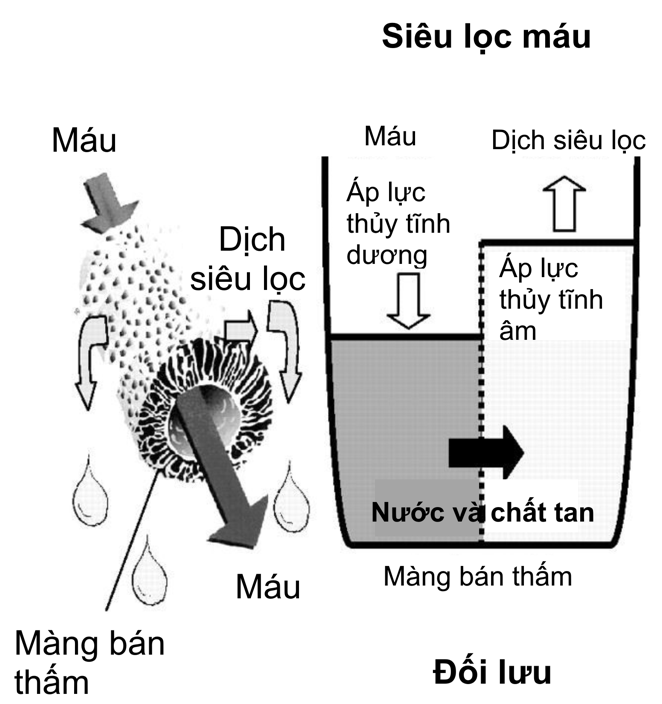
Hình 4. Cơ chế siêu lọc và đối lưu
Hệ số lọc (SC - sieving coefficient) là thông số đặc trưng cho khả năng loại bỏ chất tan của màng theo cơ chế đối lưu, hệ số lọc của một chất được tính theo công thức đơn giản:

2.4. Hấp phụ
Một số màng lọc máu liên tục có thể hấp phụ các chất hòa tan khi đi qua màng. Mức độ hấp phụ tùy vào cấu trúc, diện tích của màng. Lưu ý, hấp phụ sẽ bão hòa theo thời gian, nếu muốn tiếp tục sử dụng cơ chế hấp phụ thì cần phải thay quả lọc mới. Mặt khác, hấp phụ cũng làm giảm tính thấm của màng.
3. CÁC KỸ THUẬT LỌC MÁU TRÊN LÂM SÀNG
3.1. Siêu lọc liên tục chậm
Siêu lọc liên tục chậm (SCUF - Slow continuous ultrafiltration) là kỹ thuật sử dụng cơ chế siêu lọc để loại bỏ nước ra khỏi cơ thể trên những bệnh nhân suy tim kháng trị, quá tải dịch kháng với lợi tiểu. Trong SCUF, máu được đi qua quả lọc mà không sử dụng dịch thay thế hay thẩm tách. Lưu lượng siêu lọc trong SCUF thường thấp (< 10 mL/phút), nên tốc độ dòng máu trong SCUF có thể thấp đến khoảng 50 mL/phút là đủ. Mặc dù rất hiệu quả trong loại bỏ nước, SCUF không có hiệu quả trong việc “làm sạch” máu do lưu lượng siêu lọc thấp và không sử dụng dịch thay thế.
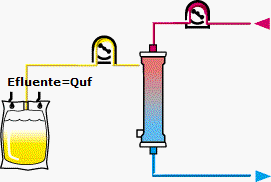
Hình 5. Sơ đồ siêu lọc liên tục chậm
3.2. Siêu lọc tĩnh mạch – tĩnh mạch liên tục
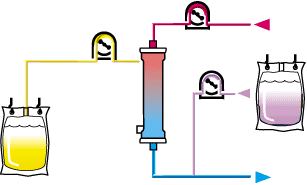
Hình 6. Sơ đồ siêu lọc tĩnh mạch – tĩnh mạch liên tục
Siêu lọc tĩnh mạch – tĩnh mạch liên tục (CVVH - Continuous veno-venous hemofiltration) là kỹ thuật sử dụng cơ chế siêu lọc, đối lưu để loại bỏ các chất có khối lượng phân tử trung bình – lớn như các chất trung gian gây viêm. Dịch thay thế đóng vai trò xuyên suốt trong CVVH. Do cần có lưu lượng siêu lọc cao để tăng khả năng loại bỏ chất bằng đối lưu, giảm thể tích tuần hoàn nặng sẽ xảy ra nhanh chóng nếu không sử dụng dịch thay thế. Mặt khác, dịch thay thế được cho đồng thời với quá trình loại bỏ chất giúp làm giảm nồng độ của chất trong máu.
Dịch thay thế có thể được cho ở trước màng lọc (hòa loãng trước màng) hoặc sau màng lọc (hòa loãng sau màng). Về lý thuyết, hòa loãng sau màng có hiệu quả nhất trong loại bỏ chất tan. Trong mode này, nồng độ chất tan trong máu đi vào quả lọc bằng nồng độ chất tan trong huyết tương. Tuy nhiên, hòa loãng sau màng bị hạn chế bởi tốc độ máu cũng như phân suất siêu lọc tối đa (thường là 25%). Phân suất siêu lọc gần đạt ngưỡng giới hạn không những làm tăng nguy cơ đông quả mà còn gây tắc các lỗ màng do nồng độ protein cao, hình thành màng thứ phát.
Xét về mặt vận chuyển vật chất, hòa loãng trước màng có một số ưu điểm so với hòa loãng sau màng. Khi hòa loãng trước màng, hematocrit và nồng độ protein toàn phần trong máu giảm đáng kể trước khi đi vào quả lọc. Điều này làm giảm nguy cơ tắc màng, đông màng và sự tập trung phân cực, giúp cải thiện quá trình vận chuyển vật chất. Hòa loãng trước màng cũng tạo thuận lợi cho quá trình vận chuyển vật chất do được tăng thêm lưu lượng ở khoang máu (lưu lượng máu cộng với dịch thay thế). Điều này làm tăng tương đối tốc độ dịch chuyển qua màng, làm giảm tương tác giữa màng – chất tan. Cuối cùng, hòa loãng trước màng có thể làm tăng vận chuyển một số chất bằng cách tạo một chênh lệch nồng độ giúp chất di chuyển ra khỏi hồng cầu.
Tuy nhiên, do độ thanh thải của một chất phụ thuộc vào nồng độ chất đó trong quả lọc, pha loãng trước màng có hiệu quả thấp tương đối liên quan đến hiện tượng hòa loãng. Điều này làm tăng lượng dịch thay thế cần sử dụng để đạt được độ thanh thải mong muốn.
Độ thanh thải trong CVVH được tính theo công thức:
Kpha loãng sau màng = SC x QUF
Kpha loãng trước màng = SC x QUF x [QP/(QP + QR)]
SC: Hệ số lọc; QUF: Lưu lượng siêu lọc; QP: Lưu lượng huyết tương; QR: Lưu lượng dịch thay thế trước quả
3.3. Thẩm tách máu tĩnh mạch – tĩnh mạch liên tục
Thẩm tách máu tĩnh mạch – tĩnh mạch liên tục (CVVHD - Continuous veno-venous hemodialysis) là kỹ thuật sử dụng cơ chế khuếch tán qua màng, trong đó dòng máu và dòng dịch thẩm tách đi ngược chiều nhau để tăng khả năng khuếch tán, chủ yếu lấy bỏ các chất hòa tan có khối lượng phân tử nhỏ, cân bằng điện giải, toan kiềm. Đồng thời, cơ chế siêu lọc cũng được dùng để lấy bỏ nước dư thừa nhưng không sử dụng dịch thay thế. CVVHD gần tương tự như thận nhân tạo kinh điển nhưng được tiến hành kéo dài hơn và lưu lượng dịch thẩm tách thấp hơn nhiều.
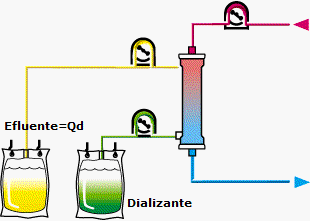
Hình 7. Sơ đồ thẩm tách máu tĩnh mạch – tĩnh mạch liên tục
Độ thanh thải trong CVVHD được tính theo công thức:
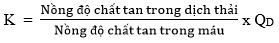
3.4. Siêu lọc – thẩm tách máu tĩnh mạch – tĩnh mạch liên tục
Siêu lọc – thẩm tách máu tĩnh mạch – tĩnh mạch liên tục (CVVHDF - Continuous veno-venous hemodiafiltration) là kỹ thuật kết hợp cả thẩm tách máu và siêu lọc – đối lưu, nó có ưu điểm của cả CVVH và CVVHD.
Độ thanh thải trong CVVHDF được tính theo công thức:
K = Lưu lượng dịch thải x Nồng độ chất trong dịch thải/Nồng độ chất trong máu
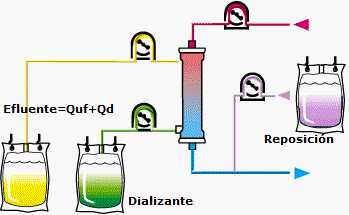
Hình 8. Sơ đồ siêu lọc – thẩm tách máu tĩnh mạch – tĩnh mạch liên tục
3.5. Thay huyết tương
Thay huyết tương là kỹ thuật đưa máu đi qua một thiết bị chuyên dụng để tách riêng huyết tương chứa các chất gây bệnh, phần huyết tương này bị loại bỏ và được thay thế bằng các dung dịch keo (albumin, huyết tương tươi đông lạnh) hoặc hỗn hợp dịch tinh thể và dịch keo.
Thay huyết tương giúp loại bỏ các chất gây bệnh: Chất trọng lượng phân tử lớn (> 15.000 Daltons), một số chất độc, phức hợp miễn dịch lưu hành trong máu, các kháng thể tự miễn, cryoglobulin, nội độc tố, thuốc/chất độc gắn với albumin, cholesterol, lipoprotein. Đồng thời bổ sung các chất bị thiếu như yếu tố đông máu, ADAMTS13.
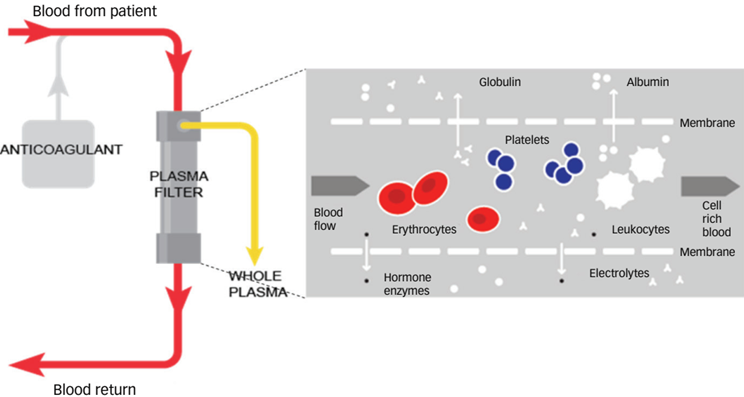
Hình 9. Sơ đồ kỹ thuật thay huyết tương
Bảng 1. Một số chỉ định thay huyết tương
|
Bệnh lý |
Chỉ định |
|
Hội chứng Guillain – Barre |
Điều trị cơ bản |
|
Suy gan cấp |
(TPE thể tích lớn) |
|
Hội chứng Goodpasture |
Có xuất huyết phế nang lan tỏa |
|
Chưa phụ thuộc lọc máu |
|
|
HC kháng phospholipid nặng |
|
|
Viêm đa rễ TK hủy myelin mạn tính |
|
|
Tăng độ nhớt máu tăng gamma globulin |
Khi có triệu chứng |
|
Nhược cơ |
Cấp tính, điều trị ngắn hạn |
|
Viêm não có kháng thể kháng receptor NMDA |
|
|
Bệnh lý vi mạch huyết khối, trung gian bổ thể |
Có tự kháng thể yếu tố H |
|
Bệnh lý vi mạch huyết khối, do thuốc |
Ticlopidin |
|
Ban xuất huyết giảm tiểu cầu huyết khối (TTP) |
|
|
Viêm mạch ANCA |
Có xuất huyết phế nang lan tỏa |
|
Creatinin ≥ 5,7 mg/dl |
|
|
Bệnh Wilson, cơn cấp |
|
|
Viêm não tủy rải rác cấp tính (ADEM) |
Đề kháng steroid |
|
Thiếu máu tan máu tự miễn nặng |
Bệnh ngưng kết lạnh |
|
Chứng cryoglobulin huyết |
Nặng, có triệu chứng |
|
Tăng cholesterol máu có tính gia đình |
Đồng hợp tử/dị hợp tử |
|
Hội chứng nhược cơ Lambert - Eaton |
|
|
Xơ cứng rải rác (MS) |
Đợt cấp/tái phát |
|
Nhược cơ |
Điều trị dài hạn |
|
Viêm tủy thị thần kinh |
Đợt cấp/tái phát |
|
Ngộ độc |
Ngộ độc nấm |
|
Lupus ban đỏ hệ thống (SLE) |
Có biến chứng nặng |
|
Cơn bão giáp |
|
Bảng 2. Tóm tắt các kỹ thuật lọc máu liên tục
|
Kỹ thuật |
Đối lưu |
Khuếch tán |
|
SCUF |
+ |
- |
|
CVVH |
++++ |
- |
|
CVVHD |
+ |
++++ |
|
CVVHDF |
+++ |
+++ |
- : Không
+ : Không đáng kể
++ : Một ít
+++ : Đáng kể
++++ : Cơ chế chính[Office1]
4. CHỈ ĐỊNH DO THẬN CỦA LỌC MÁU LIÊN TỤC
Bệnh nhân có chỉ định điều trị liệu pháp thay thế thận kèm theo một trong các tình huống:
- Huyết động không ổn định
- Tăng áp lực nội sọ
- Cần cai máy thở
- Suy tim nặng
- Thiếu máu nặng
- Tổn thương thận cấp trong bối cảnh suy đa tạng
Trong đó, chỉ định liệu pháp thay thế thận gồm:
- Quá tải thể tích
- Hội chứng ure máu cao
- Tăng kali > 6,5 mmol/L hoặc kali tăng nhanh
- Thiểu niệu hoặc vô niệu
- Toan chuyển hóa với pH < 7,20
5. CHỈ ĐỊNH NGOÀI THẬN CỦA LỌC MÁU LIÊN TỤC
5.1. Hội chứng đáp ứng viêm hệ thống và sepsis
Sepsis và các hội chứng đáp ứng viêm khác là những chỉ định ngoài thận phổ biến nhất của CRRT. Giả thuyết được đưa ra là siêu lọc máu loại bỏ các chất trung gian gây viêm (cytokin, các chất hoạt hóa bổ thể, các chất chuyển hóa của acid arachidonic, …) ra khỏi tuần hoàn, làm dập tắt đáp ứng viêm toàn thân trong khi vẫn bảo tồn các tác dụng tại chỗ có lợi.
Hiện nay, thuyết gây bệnh bởi cytokin đã được công nhận rộng rãi, theo đó tình trạng tăng cytokine máu đóng vai trò trụ cột trong nhiều bệnh lý nặng ở hồi sức như sepsis. Trước đây, nội độc tố được xem là yếu tố quan trọng nhất của vi khuẩn gây giải phóng cytokin. Gần đây, sau các nghiên cứu về thụ thể nhận dạng mẫu (PRR - pattern recognition receptors), alarmin, các mẫu phân tử liên quan mầm bệnh (PAMP - pathogen-associated molecular patterns), người ta thấy có nhiều sản phẩm khác của vi khuẩn như flagellin, lipoprotein, peptidoglycan có thể gắn với PRR làm tăng giải phóng cytokin. Ngoài ra, alarmin, các mẫu phân tử liên quan đến tổn thương (DAMP – damage - associated molecular parterns) như protein sốc nhiệt, HMGB-1 và ngay cả các tế bào hoại tử cũng có thể gắn với PRR làm tăng giải phóng cytokin. Vì vậy, các liệu pháp loại bỏ cytokin không chỉ cân nhắc ở bệnh nhân nặng do nội độc tố mà còn ở tất cả các nhiễm trùng khác và các bệnh lý nặng khác (như ARDS, viêm tụy cấp nặng) do tăng cytokin máu đóng vai trò quan trọng trong sinh lý bệnh.
Sự gia tăng các chất trung gian gây viêm và các chất trung gian kháng viêm có thể xảy ra tuần tự hoặc đồng thời tùy từng giả thuyết (Hình 10). Dù bất kể giả thuyết nào thì việc kiểm soát đỉnh viêm và kháng viêm (không chọn lọc) giúp làm giảm nhẹ tình trạng mất cân bằng trong cơ thể người bệnh, đưa hàng rào bảo vệ về gần với trạng thái sinh lý bình thường (Hình 11).
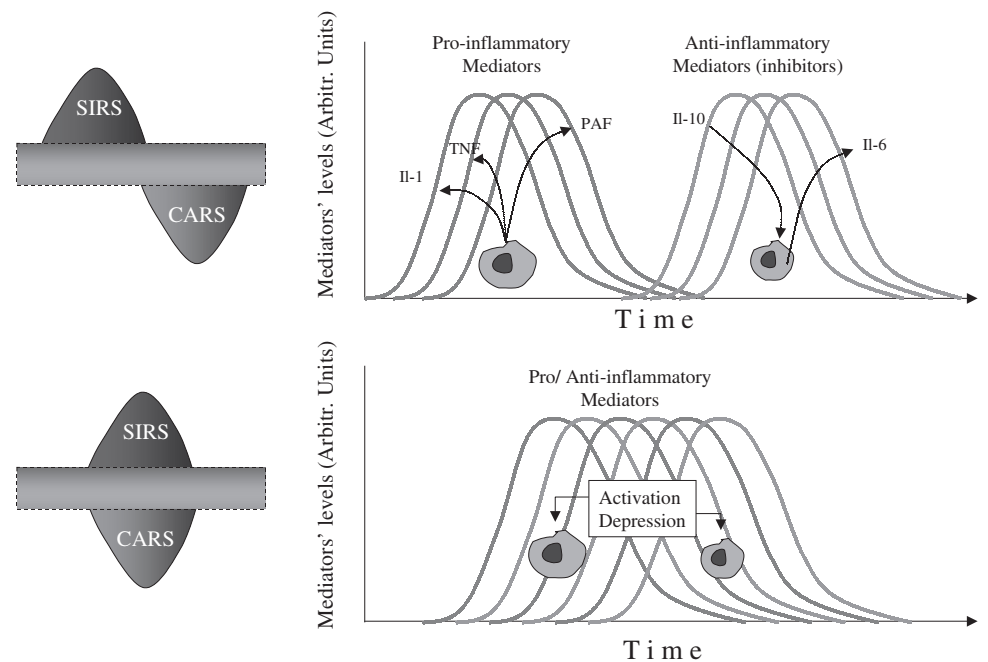
Hình 10. Giả thuyết nồng độ đỉnh trong sepsis
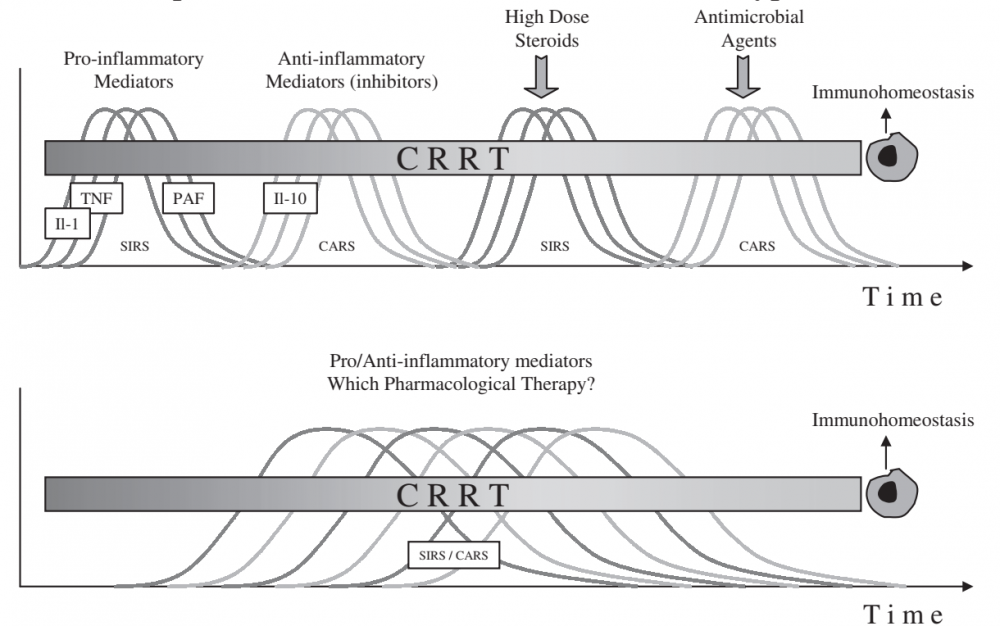
Hình 11. Vai trò của lọc máu liên tục trong kiểm soát đỉnh viêm/kháng viêm
Loại bỏ các chất trung gian gây viêm bằng siêu lọc máu
Ngoại trừ nội độc tố và dạng hoạt động sinh học của TNF có khối lượng phân tử 54,000 Da, hầu hết các chất trung gian gây viêm có khối lượng phân tử phù hợp cho việc loại bỏ bằng cơ chế đối lưu với màng lọc high flux (cut-off khoảng 30,000 Da). Tuy vậy, các báo cáo hệ số lọc của chúng thường dưới 1 (Bảng 2). Điều này có thể lý giải do giá trị cut-off của màng được thực hiện trong phòng thí nghiệm, trong điều kiện lâm sàng sẽ bị giảm do hình thành lớp màng protein. Một nguyên nhân khác là do các phân tử liên kết với nhau hoặc liên kết với tế bào nên không thể qua màng.
Một con đường loại bỏ chất trung gian khác là hấp phụ vào màng lọc. Quá trình hấp phụ này ít nhất cũng là bán chọn lọc, phụ thuộc vào cả tính chất của màng và chất trung gian. Nhìn chung, màng polyacrylonitrile có dung tích hấp phụ lớn nhất. Tuy vậy, quá trình hấp phụ này thường bão hòa sau ít giờ. Như vậy, lượng chất bị loại bỏ không chỉ phụ thuộc vào diện tích màng mà còn phụ thuộc vào tần suất thay đổi màng. Một số tác giả nghiên cứu thấy tăng lưu lượng máu hoặc lưu lượng siêu lọc làm tăng khả năng hấp phụ.
Bảng 3. Một số chất trung gian loại bỏ bằng đối lưu
|
Chất trung gian |
Khối lượng phân tử (Daltons) |
Hệ số lọc |
|
Các chất chuyển hóa của acid arachidonic |
600 |
0,5 – 0,91 |
|
Bradykinin |
1,100 |
|
|
Endothelin |
2,500 |
0,19 |
|
C3a/C5a |
11,000 |
0,11 – 0,77 |
|
Yếu tố D |
24,000 |
|
|
Chất ức chế cơ tim |
600 – 30,000 |
|
|
Lipopolysaccharid |
67,000 |
|
|
Các mảnh lipopolysaccharid |
< 1000 – 20,000 |
|
|
TNF-α |
17,000 (54,000) |
0 – 0,2 |
|
Thụ thể TNF hòa tan |
30,000 – 50,000 |
< 0,1 |
|
IL-1 |
17,500 |
0,07 – 0,42 |
|
IL-1ra |
24,000 |
0,28 – 0,45 |
|
IL-6 |
22,000 |
|
|
IL-8 |
8,000 |
0 – 0,48 |
|
IL-10 |
18,000 |
0 |
|
INF-γ |
20,000 |
|
Nghiên cứu của Hirasawa (Nhật Bản) cho thấy lọc máu liên tục với màng lọc polymethylmethacrylate (có khả năng hấp phụ cytokin) giúp loại bỏ một cách liên tục và hiệu quả nhiều loại cytokine tiền viêm và kháng viêm, làm giảm nồng độ các cytokine này trong máu. Kỹ thuật này rất hiệu quả trong điều trị bệnh nhân sepsis nặng và sốc nhiễm khuẩn, ngay cả khi không có rối loạn chức năng thận. Hiệu quả loại bỏ cytokine giảm đi khi sử dụng các loại màng khác như polyacrylonitrile do dung tích hấp phụ thấp hơn.
Một số chỉ định lọc máu liên tục:
- Sepsis nặng, sốc nhiễm khuẩn
- Hội chứng suy hô hấp cấp tiến triển – ARDS
- Tăng cytokine máu dai dẳng sau phẫu thuật
- Viêm tụy cấp nặng
- Sau ngừng tuần hoàn hô hấp
- Suy gan cấp
- Trong và sau tuần hoàn ngoài cơ thể (CPB)
- Bỏng nặng
- Đa chấn thương có sốc
5.2. Các chỉ định khác
- Suy tim sung huyết
- Hội chứng ly giải u
- Tiêu cơ vân cấp
- Nhiễm toan lactic
- Rối loạn chuyển hóa ở trẻ sơ sinh
6. BIẾN CHỨNG
Lọc máu liên tục là một biện pháp điều trị xâm lấn phức tạp nên tiềm ẩn nhiều biến chứng như:
- Hạ huyết áp
- Phản ứng với màng lọc
- Tụ máu, xuất huyết
- Rối loạn nước – điện giải
- Tắc mạch do khí, huyết khối
- Nhiễm khuẩn
Tuân thủ chặt chẽ quy trình lọc máu, theo dõi sát bệnh nhân, kết quả xét nghiệm và hoạt động của máy giúp giảm đáng kể tỷ lệ biến chứng.
7. KẾT LUẬN
Lọc máu liên tục ra đời và phát triển góp phần đáp ứng nhu cầu điều trị các bệnh nhân nặng, trở thành một cuộc cách mạng trong hồi sức cấp cứu và chống độc do làm thay đổi tiên lượng của nhiều loại bệnh vốn là thách thức của nhân loại. Lọc máu liên tục hiện nay được xem như một liệu pháp hỗ trợ đa tạng hơn là chỉ thay thế thận.
TÀI LIỆU THAM KHẢO
1. Nguyễn Gia Bình, Phạm Thế Thạch (2019), Tổng quan về lọc máu liên tục, Kỹ thuật lọc máu liên tục, Tr. 11-18. NXB Y học.
2. Đỗ Quốc Huy (2013), Vai trò lọc máu liên tục trong hồi sức cấp cứu và chống độc, CRRT Lọc máu liên tục, Tr. 11-20. NXB Y học.
3. Claure-Del Granado R, Clark WR. Continuous renal replacement therapy principles. Semin Dial. 2021 Nov;34(6):398-405.
4. Schetz M. Non-renal indications for continuous renal replacement therapy. Kidney Int Suppl. 1999 Nov;(72):S88-94.
5. Oda S, Sadahiro T, Hirayama Y et al. Non-renal indications for continuous renal replacement therapy: current status in Japan. Contrib Nephrol. 2010;166:47-53.
6. Hirasawa H. Indications for blood purification in critical care. Contrib Nephrol. 2010;166:21-30.
7. Ronco C, Tetta C, Mariano F et al. Interpreting the mechanisms of continuous renal replacement therapy in sepsis: the peak concentration hypothesis. Artif Organs. 2003 Sep;27(9):792-801.