Các xét nghiệm HBsAg đầu tiên được thực hiện bằng kỹ thuật khuếch tán miễn dịch hai chiều Ouchterlony, nhưng sau đó các kỹ thuật với độ nhạy cao hơn ( như RIA và ELISA) đã được áp dụng. Ngày nay, mặc dù việc thực hiện các xét nghiệm HBsAg đang có đã thay đổi đáng kể và sàng lọc máu hiện nay ở Liên minh châu Âu (EU) cần độ nhạy là 0,13 IU / mL, nhưng một số kỹ thuật với độ nhạy cao hơn (<0,013 IU / ml) đã có sẵn. Hơn nữa, để phát hiện hiệu quả các đột biến HBsAg, các kỹ thuật trong đó có bao gồm nhiều kháng thể đơn dòng trong giai đoạn bắt giữ cùng với một cộng hợp kháng thể đa dòng thường được ưa chuộng [3], [9]. Dưới đây trình bày một số kỹ thuật quan trọng, sử dụng phổ biến tại các bệnh viện hiện nay.
1. Kỹ thuật ngưng kết hồng cầu thụ động ngược (RPHA)
Nguyên lý: xét nghiệm HBsAg RPHA
- Gắn AntiHBs trên bề mặt hồng cầu cừu. Tiến hành phản ứng trực tiếp bằng cách nhỏ huyết thanh thử vào vào huyền dịch AntiHBs trong một giếng nhựa. Để yên 60 phút. Nếu trong huyết thanh thử có HBsAg thì hiện tượng ngưng kết sẽ xảy ra do hồng cầu cừu sẽ tụ tập lại một cách thụ động. Đọc kết quả bằng mắt thường.
- Phản ứng âm tính khi không có hiện tượng ngưng kết xảy ra: xuất hiện hình nút hoặc hình vòng nhẫn của các hồng cầu không ngưng kết lắng xuống đáy giếng.
- Phản ứng dương tính khi có hiện tượng ngưng kết xảy ra, không có hình nút hoặc vòng nhẫn [5], [10].
Ưu điểm: không cần dụng cụ đắt tiền, cách tiến hành đơn giản, đọc kết quả bằng mắt thường nên còn được ứng dụng rộng rãi để chẩn đoán các bệnh khác.
Nhược điểm: ít nhạy so với kỹ thuật ELISA [11], [12].
2. Kỹ thuật miễn dịch sắc ký
Nguyên lý: test nhanh HBsAg
- Dùng AntiHBs đơn dòng và AntiHBs đa dòng cố định trên que thử bằng giấy thấm để phát hiện sự có mặt của HBsAg trong huyết thanh.
- Khi cho que thử tiếp xúc với huyết thanh thử theo qui định, huyết thanh thử sẽ thấm dần lên trên. Nếu trong mẫu thử có HBsAg thì AntiHBs đơn dòng có gắn hạt keo vàng sẽ kết hợp với kháng nguyên và hình thành phức hợp kháng nguyên- kháng thể làm xuât hiện màu hồng ở vạch T (vạch thử). Huyết thanh tiếp tục mao dẫn lên trên, kết hợp với kháng huyết thanh đa dòng AntiIgG làm xuất hiện màu hồng ở vạch C (vạch chứng).
- Nếu trong mẫu huyết thanh thử không có HBsAg thì sẽ không xuất hiện màu hồng ở vạch T, nghĩa là không xảy ra phản ứng ngưng kết giữa HBsAg và AntiHBs, nhưng tại vạch C vẫn xuất hiện màu hồng vì có sự ngưng kết của nhiều loại IgG trong mẫu huyết thanh với kháng huyết thanh đa dòng AntiIgG.
- Kết quả dương tính khi xuất hiện 2 vạch rõ ràng và kết quả âm tính khi xuất hiện một vạch C [14], [15], [16].
Ưu điểm của miễn dịch sắc ký
- Qui trình đơn giản, nhanh: chỉ trong vài phút, đọc kết quả bằng mắt thường. Cùng với kỹ thuật ngưng kết, kỹ thuật test nhanh được WHO khuyến cáo là có thể dùng sàng lọc máu ở những phòng xét nghiệm qui mô nhỏ, ở nơi xa xôi hẻo lánh hoặc trong những tình huống cấp cứu [65]. Hiện nay, test nhanh HBsAg được áp dụng để sàng lọc người hiến máu tại địa điểm tổ chức hiến máu tình nguyện, sau đó tiến hành sàng lọc đơn vị máu hiến một lần nữa bằng kỹ thuật ELISA hoặc hóa phát quang tại phòng xét nghiệm
Nhược điểm của miễn dịch sắc ký
- Phụ thuộc vào đánh giá chủ quan của người đọc [15]
- Có một tỉ lệ âm tính giả nhất định. Nghiên cứu tại Viện Huyết học- Truyền máu Trung ương năm 2011 cho thấy tỉ lệ dương tính HBsAg ELISA là 1,07% trên những đơn vị máu trước đó đã được sàng lọc bằng test nhanh HbsAg [14], [16].
3. Kỹ thuật miễn dịch gắn enzym (ELISA)
Nguyên lý ELISA:
- Kháng thể (hoặc kháng nguyên) đã biết được cố định trên pha rắn, các pha rắn thường dùng nhất là:
+ Ở mặt đáy và mặt bên thành các giếng nhựa
+ Trên bề mặt các hạt polystyren hoặc nguyên liệu khác
+ Trên bề mặt các dụng cụ đặc biệt, dùng một lần cho các hệ thống tự động. Các bề mặt thay đổi tùy theo nhà sản xuất, tuy nhiên thường dùng nguyên liệu polystyren với nguyên lý như trên
+ Các giải hoặc màng nitrocellulose. Cách này thường dùng trong phương pháp Western blot [6], [7], [8], [15].
- Enzym được dùng để đánh dấu, có trong thành phần dung dịch cộng hợp. Thường dùng horseradish peroxidase (HRP) hoặc alkalin phosphatase để phát hiện phức hợp miễn dịch được tạo thành do hoạt động của các enzym này làm cho cơ chất không màu ở dạng bất hoạt trở thành có màu khi chuyển sang dạng hoạt hóa.
- Enzym cộng hợp cùng với hệ thống hiện màu đóng vai trò là hệ thống phát hiện phức hợp kháng nguyên- kháng thể được tạo thành.
- Đọc kết quả: dựa vào máy đọc ELISA. Đậm độ màu của phản ứng tỉ lệ với lượng kháng nguyên (hoặc kháng thể) cần xác định. (Nguyên lý ELISA cạnh tranh thì tỉ lệ nghịch, nguyên lý ELISA sandwich thì tỉ lệ thuận).
- Độ nhạy và độ đặc hiệu của ELISA khác nhau tùy theo loại sinh phẩm sử dụng.
Qui trình thực hiện kỹ thuật ELISA: gồm có các bước cơ bản như sau
Nhỏ huyết thanh cần xác định vào giếng nhựa
Ủ lần 1 (nếu có). Rửa sạch (nếu có ủ). Thêm dung dịch cộng hợp
Ủ lần 2. Rửa sạch bằng dung dịch đệm để loại bỏ các chất không gắn
Thêm dung dịch hiện màu. Ủ trong tối. Thêm dung dịch hãm màu.
Đọc kết quả bằng cách đo mật độ quang của giếng và so sánh với giá trị cắt COV (Cut off value). Cách tính COV theo hướng dẫn sử dụng của nhà sản xuất, ví dụ thông số của hãng Phamatech: COV = NC x 2,1
NC : Mật độ quang đo được của trung bình hai chứng âm.
PC : Mật độ quang đo được của trung bình hai chứng dương.
S : Mật độ quang đo được của mẫu thử.
+ Kết quả dương tính khi: S ≥ COV.
+ Kết quả âm tính khi: S < COV.
+ Khi S = COV± 10% : không xác định. Lặp lại xét nghiệm một lần nữa. Nếu mẫu làm lại có S ≥ COV thì xem như dương tính [5], [15].
Ưu điểm của kỹ thuật ELISA
- Độ nhạy và độ đặc hiệu cao. Độ nhạy của kỹ thuật ELISA tương đương với kỹ thuật miễn dịch phóng xạ và cao hơn kỹ thuật miễn dịch huỳnh quang (0,1 µg/ml).
- ELISA có thể phát hiện được kháng nguyên ở nồng độ 0,00001 µg/ml [16].
Nhược điểm của kỹ thuật ELISA
Thời gian thực hiện xét nghiệm ELISA cho mỗi lô xét nghiệm: 1- 2 giờ.
Qui trình thực hiện phức tạp.
4. Kỹ thuật miễn dịch enzym vi hạt (MEIA)
- Phương pháp ELISA cải tiến mới đây dùng các vi hạt (microparticles) và phương tiện vi tính cho ra các xét nghiệm miễn dịch enzym vi hạt (MEIA) khá nhanh (45 phút) và hoàn toàn tự động [14].
- Nguyên lý cơ bản của thử nghiệm vi hạt khác với thử nghiệm trên giếng là toàn bộ bề mặt của hạt gelatin hoặc hoặc hạt latex có kích thước khoảng 1nm trong huyền dịch với đệm thích hợp. Mỗi thử nghiệm dùng một thể tích huyền dịch, trong đó bao gồm hàng triệu hạt nhỏ. Các hạt này cung cấp diện tích bề mặt lớn cho phản ứng. Phần lớn thử nghiệm vi hạt được thiết kế cho hệ thống chuyên dụng và chứa trong các giếng nhỏ, trong đó xảy ra phản ứng. Nguyên lý kỹ thuật và phương pháp giống như kỹ thuật ELISA. Hệ máy PRISM và AxSYM của hãng Abbott là các ví dụ về thử nghiệm này [1], [2], [4].
5. Kỹ thuật miễn dịch điện hóa phát quang (ECLIA)
Kỹ thuật này được thực hiện trên máy tự động hoàn toàn.
Nguyên lý
- Dùng kháng thể đã biết để phát hiện kháng nguyên chưa biết, và ngược lại.
- Dùng hệ thống phát hiện là điện hoá phát quang để nhận biết được sự hiện diện của phức hợp kháng nguyên- kháng thể.
Kỹ thuật bao gồm các phản ứng:
- Phản ứng miễn dịch: kháng nguyên kết hợp đặc hiệu với kháng thể được đánh dấu bằng ruthenium. Sử dụng sự tương tác của biotin và streptavidin cùng với các vi hạt có từ tính để gắn phức hợp kháng nguyên-kháng thể (đánh dấu bằng ruthenium) vào pha rắn.
- Phản ứng điện hoá phát quang: để phát hiện sự hiện diện của phức hợp kháng nguyên- kháng thể đánh dấu bằng ruthenium. Dưới tác dụng của điện, phức hợp ruthenium phản ứng với tripropylamine (TPA) và phát quang.
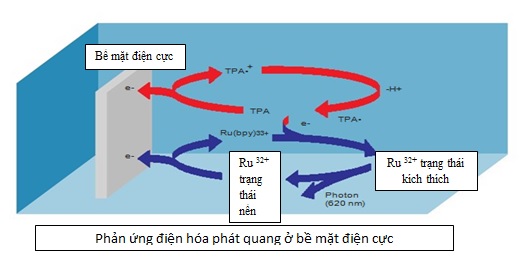

Hình 1. Phản ứng điện hóa phát quang tại bề mặt điện cực [13]
Kết quả phản ứng điện hóa phát quang là tín hiệu ánh sáng được máy ghi nhận và suy ra nồng độ ban đầu của kháng nguyên hoặc kháng thể có trong mẫu thử.
Kỹ thuật miễn dịch điện hóa phát quang sử dụng chất đánh dấu là ruthenium khởi phát từ điện chứ không phải từ phản ứng hóa học, vì vậy có khả năng phát hiện chất có nồng độ thấp và cho kết quả rất nhanh, trong khoảng 18 phút. Các kháng thể (hoặc kháng nguyên) gắn biotin và chất đánh dấu ruthenium cùng vi hạt phủ streptavidin được ủ trong hỗn hợp phản ứng. Khi đặt một điện thế lên điện cực buồng đo, phức hợp ruthenium tác dụng với prophylamine, chuyển sang trạng thái kích thích, và tín hiệu phát quang được hình thành. Tín hiệu ánh sáng được đo và kết quả xét nghiệm được xác định qua đường chuẩn xét nghiệm đã được thiết lập. Một đường cong qui chiếu được ghi nhớ trong một thanh đã mã hóa các thuốc thử và được xác định một lần nữa bởi máy phân tích tự động bởi một đường chuẩn ở hai điểm [11], [12], [13].
Nguyên lý ECLIA kiểu sandwich
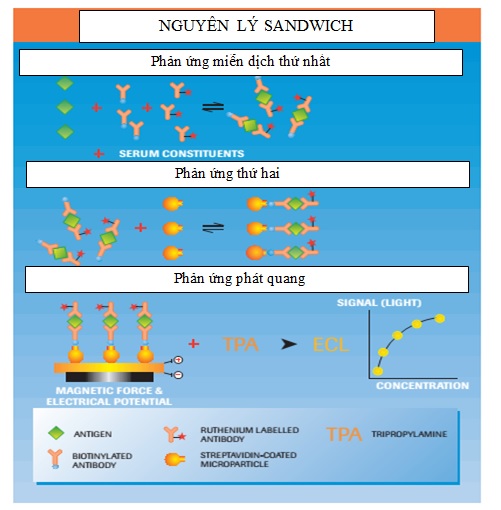

Hình 2. Nguyên lý sandwich của kỹ thuật miễn dịch điện hóa phát quang [13]
+ Ở bước đầu tiên, trong một ống phản ứng, mẫu thử được cho vào cùng với antiHBs đơn dòng gắn biotin và một hỗn hợp antiHBs đơn dòng- đa dòng được đánh dấu bằng ruthenium. Trong quá trình ủ 9 phút, các kháng thể sẽ bắt giữ HBsAg nếu có trong mẫu thử.
+ Ở bước thứ hai, các vi hạt từ tính có áo một lớp streptavidin được thêm vào. Trong quá trình ủ 9 phút, phức hợp kháng nguyên kháng thể gắn vào pha rắn do tương tác giữa biotin và streptavidin.
+ Sau khi ủ lần 2, hỗn hợp phản ứng chứa phức hợp miễn dịch được chuyển đến buồng đo; chỉ phức hợp miễn dịch có từ tính bị bắt giữ bởi từ trường ở bề mặt điện cực, còn những thành phần thuốc thử và mẫu thử khác sẽ bị rửa trôi đi.
+ Trong phản ứng điện hóa phát quang, phức hợp miễn dịch được giữ lại ở điện cực có chứa ruthenium, dưới tác dụng kích thích của điện, sẽ tác dụng với triprophylamine (TPA) và phát quang. Tín hiệu ánh sáng thu được tỉ lệ thuận với lượng HBsAg có trong mẫu thử [11], [12], [13], [17].
Qui trình kỹ thuật
Đặt hóa chất cần thử vào máy, chạy mẫu chuẩn và mẫu chứng.
Tách 200 µl huyết thanh cho vào ống eppendort, đặt vào máy.
Khai báo các thông tin của mẫu thử, yêu cầu xét nghiệm, ấn nút khởi động.
Máy sẽ tự động đưa ra kết quả sau khi làm xong.
Thời gian: 18 phút.
- Đọc kết quả:
+ Kết quả được máy xác định tự động bằng phần mềm, bằng cách so sánh tín hiệu ánh sáng có được từ sản phẩm phản ứng với tín hiệu của giá trị cắt có trước bằng các chuẩn đã biết trước nồng độ.
+ Kết quả dương tính khi chỉ số cắt (coi: cut off index) của mẫu thử ≥ 1.
+ Kết quả âm tính khi coi của mẫu thử < 0,9.
+ Khi 0,9 ≤ coi < 1: lặp lại xét nghiệm lần nữa. Khi mẫu lần hai có coi ≥ 0,9 thì được xem là dương tính
Ưu điểm của kỹ thuật ECLIA
Độ nhạy và độ đặc hiệu cao [11], [13], [17]..
Qui trình thực hiện xét nghiệm đơn giản.
Thời gian xét nghiệm nhanh.
Chèn được mẫu ưu tiên khi máy đang thực hiện xét nghiệm.
Được xem như là một trong những phương pháp hiện đại nhất xét nghiệm các chất như nội tiết tố, chất chỉ điểm ung thư [26]
Nhược điểm của kỹ thuật ECLIA: Thiết bị đắt tiền, giá thành cao.
Các kỹ thuật nêu trên đều là những kỹ thuật chẩn đoán huyết thanh học, cho nên đều có nhược điểm chung là có thể không phát hiện các dấu ấn huyết thanh trong các trường hợp như mức độ nhân lên của virus quá thấp, đột biến preS/S hoặc đột biến core/precore...[3], [17].
Việc lựa chọn và chỉ định sử dụng các kỹ thuật tùy thuộc vào mức độ trang bị và yêu cầu lâm sàng, trong các trường hợp sàng lọc trong truyền máu thì phải tuân thủ theo quy định để đảm bảo an toàn truyền máu [15].
TÀI LIỆU THAM KHẢO
1. Nguyễn Đạt Anh, Nguyễn Thị Hương, Lương Tấn Thành (2012), "Huyết thanh học chẩn đoán virus viêm gan B", Các xét nghiệm thường quy áp dụng trong thực hành lâm sàng, Nhà xuất bản Y học, tr. 237-248.
2. Bùi Đại (2002), "Tổng quan về các loại viêm gan virus. Các xét nghiệm trong viêm gan virus", Viêm gan virus B và D, Nhà xuất bản Y học, tr. 21-26, 218-236.
27. Lê Minh Hồng, Nguyễn Thạc Tuấn, Nguyễn Anh Trí (2003), "Khảo sát dấu ấn HBeAg và AntiHBe ở người có HBsAg dương tính", Tạp chí Y học thực hành, Số 2, tr. 96-98.
3. Đỗ Thị Thu Hương, Trần Ngọc Thạnh, Phạm Hùng Vân, Võ Đức Xuyên An (2011), "Nghiên cứu kiểu gen, đột biến kháng thuốc và đột biến tiền lõi của virus viêm gan B trên bệnh nhân viêm gan mạn tại Đà Nẵng", Tạp chí Khoa học Tiêu hóa Việt Nam, Tập VI, Số 24, tr. 1628-1633.
4. Trần Văn Huy (2003), "Nghiên cứu các dấu ấn của các virus viêm gan B, C và đặc điểm lâm sàng, cận lâm sàng của ung thư biểu mô tế bào gan", Luận án Tiến sĩ Y học Trường Đại học Y khoa Huế.
5. Atlas Link INC. (2007), "Introduction for use of Hepatitis B virus e antigen ELISA Kit", pp.1-5.
6. Abe K. (2004), "Molecular epidemiolgy of hepatitis B virus and its clinical significance", Tạp chí Thông tin Y Dược, Số chuyên đề gan mật, tr. 47-50.
7. Barlow K, Perry K. (2009), "Evaluation of the Roche HBsAg II assay", Microbiological Diagnostics Assessment Service. Health Protection Agency, Centre for Infections, London, Report PER07003, pp. 1-21.
8. Burmester GR, Pezzutto A et al. (2003), "Laboratory Applications", Color Atlas of Immnunology Thieme, pp. 76-87.
9. Chen P, Yu C, Wu W, Wang J, Ruan B, Ren J, Yang S, Xu K, Yu L, Li L. (2013), "Serolological Profile Among HBsAg-Positive Infections in Southeast China: A Community-Based Study", Hepat Mon., 13(1): http://www.ncbi.nlm.nih.gov/ pubmed/23483608
10. Krajden M, McNabb G, Petric M. (2005), "The laboratory diagnosis of hepatitis B virus", Can J Infect Dis Med Microbiol, 16(2), pp. 65-72.
11. Louisirirotchanakul S, Khupulsup K, Akraekthalin S, Chan KP, Saw S, Aw TC, Cho DH, Shin MG, Lim J. (2010), "Comparison of the technical and clinical performance of the Elecsys HBsAg II assay with the Architect, AxSym, and Advia Centaur HBsAg screening assays", J Med Virol., 82(5), pp. 755-762.
12. Maylin S, Boyd A, Martinot-Peignoux M, Delaugerre C, Bagnard G, Lapalus M, Zoulim F, Lavocat F, Marcellin P, Simon F, Girard PM, Lacombe K. (2013), "Quantification of hepatitis B e antigen between Elecsys HBeAg and Architect HBeAg assays among patients infected with hepatitis B virus", J Clin Virol., 56(4), pp. 306-311.
13. Wursthorn K, Jaroszewicz J, Zacher BJ, Darnedde M, Raupach R, Mederacke I, Cornberg M, Manns MP, Wedemeyer H. (2011), "Correlation between the Elecsys HBsAg II assay and the Architect assay for the quantification of hepatitis B surface antigen (HBsAg) in the serum", J Clin Virol, 50(4), pp. 292-306
14. WHO (2010), "Screening donated blood for transfusion- transmissible infection: Recommendations", World Health Organization, pp. 25-29.
15. WHO (2014), "Blood safety and availability", Fact sheet No279, Updated June 2014
16. WHO (2014), "Hepatitis B", Fact sheet N0 204, Updated June 2014
17. Xu W, Li Y, Wang M, Gu J. (2011), "Comparison of two immunoassays for determining hepatitis B virus serum markers", Clin Chem Lab Med, 50(1), pp.153-157.
PGS.TS. Trần Đình Bình
Bộ môn Vi sinh, Khoa Kiểm soát nhiễm khuẩn
Bệnh viện Trường Đại học Y Dược Huế







_698d8500d21e8.jpg)
_69771e42e3d16.png)

